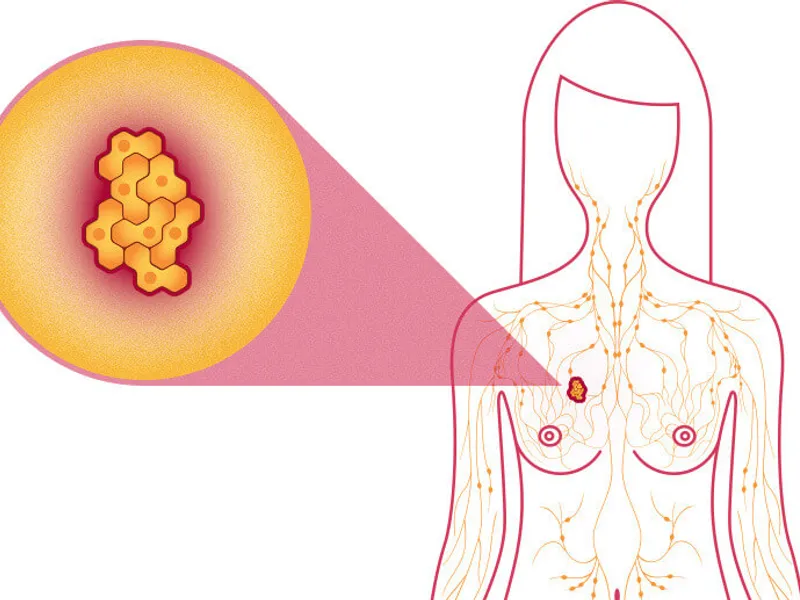
AstraZeneca a declarat că medicamentul, Lynparza, a fost aprobat pentru pacienţii cu o formă de cancer la sân în stadiu incipient, cu risc ridicat, cu mutaţii genetice, numită HER2-negativ cu mutaţie BRCA, care au fost deja trataţi cu chimioterapie înainte sau după operaţie.
Aprobarea s-a bazat pe rezultatele unui studiu în stadiu avansat în care medicamentul a arătat o îmbunătăţire statistică şi clinică semnificativă a supravieţuirii fără boli invazive, reducând riscul de recidivă invazivă a cancerului de sân şi al doilea cancer sau deces cu 42% în comparaţie cu placebo.
Lynparza conduce o clasă de medicamente cunoscute sub numele de inhibitori PARP
Lynparza conduce o clasă de medicamente cunoscute sub numele de inhibitori PARP, care împiedică celulele canceroase deteriorate de chimioterapie să se repare.
Este un atu-cheie pentru AstraZeneca, cu aprobări pentru cancerul ovarian, de prostată şi pancreas.
În 2020, 2,3 milioane de femei au fost diagnosticate cu cancer la sân şi au avut loc 685.000 de decese la nivel global din cauza acestei boli, conform Organizaţiei Mondiale a Sănătăţii.
În urma aprobării de către SUA a Lynparza, AstraZeneca va primi o plată în valoare de 175 milioane dolari din partea Merck, care era condiţionată de această autorizare.